Nga
Sëmundja e Alzheimerit, një çrregullim neurodegjenerativ progresiv që prek rreth 55 milionë njerëz në mbarë botën, çon në rënie të rëndë njohëse dhe humbje të kujtesës. Studiuesit në Institutin e Shkencës dhe Teknologjisë në Okinawa kanë zhvilluar një peptid sintetik, PHDP5, që synon Alzheimer në fazën e hershme duke siguruar disponueshmërinë e dinaminës për riciklimin e vezikulave në neurone, duke demonstruar një restaurim domethënës të kujtesës dhe funksionet e të mësuarit te minjtë transgjenikë.
Një trajtim i ri është treguar se lufton në mënyrë efektive rënien njohëse te minjtë me sëmundjen Alzheimer.
Alzheimer Sëmundja, një çrregullim neurodegjenerativ progresiv, qëndron si shkaku kryesor i demencës. Kjo gjendje çon në përkeqësim kognitiv, humbje të kujtesës dhe përfundimisht i bën individët të paaftë për të kryer aktivitetet e përditshme. Aktualisht, ajo prek rreth 55 milionë njerëz në mbarë botën. Në Japoni, rreth 4.4 milionë njerëz vuajnë nga demenca, me parashikimet që sugjerojnë se kjo shifër do të rritet në 6.5 milionë deri në vitin 2060, sipas statistikave të qeverisë.
Kurimi ose vonimi i simptomave dobësuese të Alzheimerit është jashtëzakonisht i vështirë për shkak të natyrës së pakapshme të sëmundjes. Shkaku i saktë është i panjohur dhe ka të ngjarë të përfshijë faktorë të shumtë nga gjenetika tek mënyra e jetesës, dhe për shkak të natyrës progresive të gjendjes, shpesh është tepër vonë për t’u trajtuar në mënyrë efektive pasi simptomat fillojnë të ndikojnë në jetën e përditshme.
Megjithatë, një ekip studiuesish nga ish Njësia e Funksionit Sinaptik Qelizor dhe Molekular në Institutin e Shkencës dhe Teknologjisë në Okinawa (OIST), i udhëhequr nga Profesor Emeritus Tomoyuki Takahashi, tani ka bërë përparim në gjetjen e një trajtimi të zbatueshëm të këtyre simptomave, duke na vënë në rruga për të shpëtuar funksionet e trurit përpara se të dëmtohen në mënyrë të pakthyeshme nga sëmundja e Alzheimerit. Gjetjet e tyre janë publikuar së fundmi në Hulumtimi i trurit. “Ne i kthyem me sukses simptomat e sëmundjes së Alzheimerit tek minjtë,” shpjegon Dr. Chia-Jung Chang, autori i parë i studimit dhe aktualisht anëtar i Njësisë së Llogaritjes Neurale në OIST. “Ne e arritëm këtë me një peptid të vogël, sintetik, PHDP5, që mund të kalojë lehtësisht barrierën gjaku-tru për të synuar drejtpërdrejt qendrën e kujtesës në tru.”
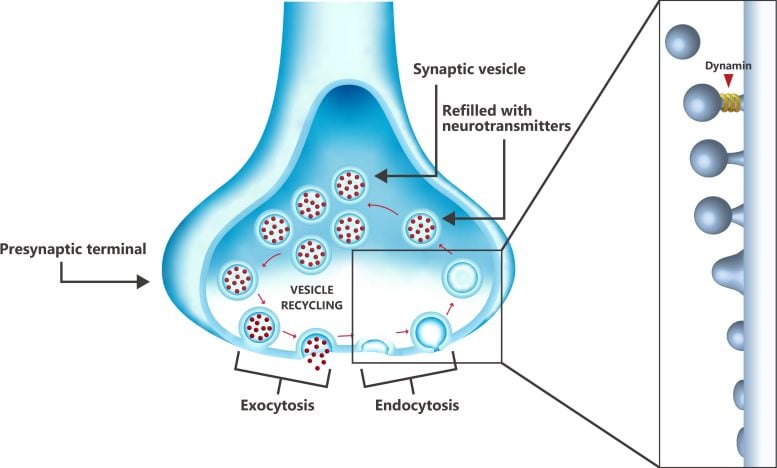
Riciklimi i vezikulave në terminalin presinaptik në njërin skaj të një neuroni, duke treguar rolin e dinaminës gjatë hapit të fundit të endocitozës (rikthimi i membranës), ku proteina shkëput vezikulën nga membrana qelizore. Vezikula më pas mbushet me neurotransmetues dhe transportohet përsëri në vendin e lëshimit të membranës qelizore, ku lëshohen neurotransmetuesit dhe fshikëza riciklohet. Kredia: Kaori Serakaki/OIST
Kursimi i dinaminës
Një faktor qendror në sëmundjen e Alzheimerit është shëndeti i sinapseve të trurit. Sinapset janë lidhjet ndërmjet neuroneve në tru, ku informacioni përcillet nga një neuron në tjetrin përmes neurotransmetuesve kimikë të mbështjellë në vezikulat sinaptike. Këto fshikëza duhet të riciklohen vazhdimisht për të siguruar një furnizim të qëndrueshëm dhe një hap thelbësor në procesin e riciklimit të fshikëzave është marrja e membranës (endocitoza) nga dinamina e proteinës, e cila ‘shkëput’ vezikulën nga membrana qelizore. Dinamina është e disponueshme në të gjithë neuronet, qoftë lirisht ose e lidhur me mikrotubulat që përbëjnë citoskeletin e qelizave.
Antagonisti kryesor këtu është proteina tau, e cila në rrethana normale është e përfshirë në stabilizimin e mikrotubulave. Megjithatë, në fazën e hershme të Alzheimerit, tau fillon të shkëputet nga mikrotubulat. Duke qenë i disponueshëm lirisht, tau mbi-monton mikrotubula të reja, duke e fshirë në mënyrë efektive dinaminën nga qeliza, duke e bërë atë të padisponueshme për hapin e fundit të endocitozës. Ndërsa Alzheimer përparon, tau i akumuluar grumbullohet në lëmsh neurofibrilare, të cilat janë shenjë dalluese e sëmundjes – në kohën kur këto ngatërrime shfaqen në skanimet e trurit, shpesh është tepër vonë për të trajtuar sëmundjen.
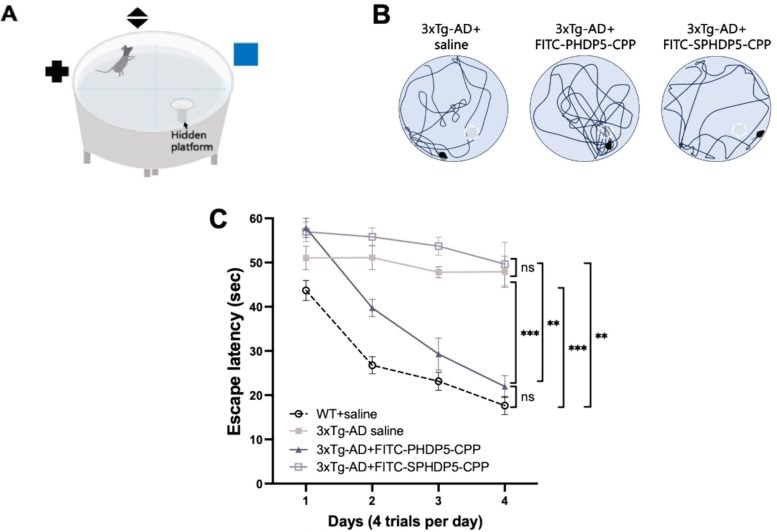
Disa nga gjetjet kryesore nga punimi. SPHDP5 është një peptid i fërguar që nuk ka efekt terapeutik, i përdorur si kontroll. A) tregon konfigurimin eksperimental me një labirint uji Morris, ku një mi futet në një banjë uji dhe stërvitet për të gjetur një platformë të fshehur duke përdorur shenja vizuale. B) janë ilustrime përfaqësuese të shtigjeve të notit të minjve drejt platformës së fshehur (vija e bardhë e ndërprerë). C) tregon efektin e administrimit intranazal të PHDP5 me kalimin e kohës – vini re se si kthesat për minjtë e shëndetshëm (vija e zezë e ndërprerë) dhe minjtë transgjenikë të trajtuar me PHDP5 (vija gri me trekëndësha) janë shumë të ngjashme. Kredia: Chang et al.
Studiuesit e OIST u përqendruan veçanërisht në ndërveprimin dinamin-mikrotubul, dhe ata kanë provuar më parë efektet pozitive të frenimit të këtij ndërveprimi in vitro duke përdorur peptidin sintetik PHDP5. Dr. Zacharie Taoufiq, aktualisht në Njësinë e Biologjisë Synapse në OIST dhe autori i dytë i punimit, shpjegon: “Duke parandaluar ndërveprimin midis dinaminës dhe mikrotubulave, PHDP5 siguron që dinamina të jetë e disponueshme për endocitozën e vezikulave gjatë riciklimit, gjë që mund të rivendosë komunikimin e humbur midis neuroneve brenda sinapseve në një fazë të hershme.”
Duke përdorur minj transgjenikë, studiuesit tani kanë treguar të njëjtin efekt restaurues in vivo. “Ne ishim të emocionuar kur pamë se PHDP5 shpëtoi ndjeshëm deficitin e të mësuarit dhe kujtesës tek minjtë,” thotë Dr. Chang. “Ky sukses nxjerr në pah potencialin e synimit të ndërveprimit dinamin-mikrotubul si një strategji terapeutike për sëmundjen e Alzheimerit.”
Për shkak se PHDP5 pengon ndërveprimet dinamin-mikrotubul në përgjithësi, studiuesit modifikuan peptidin për të përfshirë një peptid depërtues në qelizë, i cili lejon që trajtimi të administrohet përmes zgavrës së hundës, ku pengesa gjaku-tru nuk është zhvilluar plotësisht dhe që është afër qendra e kujtesës së trurit, hipokampusi. Në këtë mënyrë, peptidi do të shpërndahet në hipokampus në një përqendrim më të lartë sesa përmes metodave të tjera të administrimit, duke minimizuar gjithashtu efektet anësore të mundshme gjetkë në trup.
Nga molekulat dhe labirintet tek trajtimet e qëndrueshme
Me kusht që sinapset të trajtohen me PHDP5 në një fazë relativisht të hershme, dëmi i shkaktuar nga ndërveprimi i shfrenuar i dinaminës-mikrotubulave mund të rikthehet deri në pikën që minjtë transgjenikë të trajtuar të kenë aftësi të të mësuarit dhe kujtesës në të njëjtin nivel me minjtë e shëndetshëm. Ndërsa peptidi nuk mund të shërojë Alzheimer-in, frenimi i ndërveprimit dinamin-mikrotubul vonon ndjeshëm rënien njohëse, deri në pikën ku mund të mos prekë njerëzit e shëndetshëm brenda një jetëgjatësie normale.
I inkurajuar nga këto rezultate, ekipi hulumtues, i kryesuar tani nga Dr. Taoufiq dhe i përbërë nga specialistë nga njësi të ndryshme në të gjithë OIST, po vazhdon punën e tyre për trajtimin. Dr. Taoufiq, me bazë në Njësinë e Biologjisë Synapse, po punon për të përmirësuar vetë peptidin dhe mënyrat në të cilat ai funksionon in vivo. “Ne duam të rrisim sasinë e PHDP5 në tru për të arritur efekte më të mira, duke minimizuar efektet anësore”, siç thotë ai. Ndërkohë, Dr. Chang, me bazë në Njësinë e Llogaritjes Neurale, po punon për të futur AI në kërkim të të dhënave shtesë dhe më të forta: “Ne po përdorim fusha të ndryshme të ekspertizës brenda OIST për të përmirësuar kërkimin tonë.”
Në të njëjtën kohë, ekipi po punon me divizionin e Inovacionit OIST për të lëvizur peptidin përmes tubacionit të prodhimit. “Ne duam të përfshijmë kompanitë farmaceutike në vazhdim”, shpjegon Dr. Taoufiq. “Ata kanë ekspertizën e nevojshme në farmakologji dhe kapacitetin për prova njerëzore për ta kthyer peptidin tonë në një trajtim të zbatueshëm.”
Ndërsa udhëtimi nga kërkimi në ilaç është jashtëzakonisht i gjatë, duke marrë mesatarisht 20 vjet nga letra në recetë, studiuesit mbeten shumë entuziastë. Siç thotë Dr. Chang, “Vaksina e koronavirusit na tregoi se trajtimet mund të zhvillohen me shpejtësi, pa sakrifikuar ashpërsinë ose sigurinë shkencore. Ne nuk presim që kjo të shkojë aq shpejt, por ne e dimë se qeveritë – veçanërisht në Japoni – duan të trajtojnë sëmundjen e Alzheimerit, e cila po prek kaq shumë njerëz. Dhe tani, ne kemi mësuar se është e mundur për të rikthyer në mënyrë efektive rënien njohëse nëse trajtohet në një fazë të hershme.”
Koment nga Profesor Emeritus i OIST Tomoyuki Takahashi
Ndërsa tani është në pension nga OIST, Prof. Takahashi filloi projektin dhe e drejtoi atë deri në mbylljen e njësisë. “Në këtë studim, së bashku me atë të mëparshëm, kemi sqaruar rëndësinë patologjike të ndërveprimit dinamin-mikrotubul (MT) në sëmundjen e Alzheimerit (AD), nga i cili funksionet sinaptike dëmtohen ndjeshëm. Frenuesi dynamin-MT PHDP5 shpëton mosfunksionimet sinaptike të shkaktuara nga akumulimi i tau në feta të trurit dhe mund të kthejë deficitet e të mësuarit dhe të kujtesës në nivele normale në modelet transgjenike të minjve AD. Ky efekt in vivo është i fortë pasi është i riprodhueshëm në testet dyfish të verbër dhe i qëndrueshëm në dy lloje të minjve model. Është e qartë se hapi tjetër vendimtar është të dorëzohet PHDP5 në testet e Fazës 1-4 të sprovave terapeutike të AD, të cilat do të kryheshin më së miri nga kompanitë farmaceutike. Ne shpresojmë fuqimisht që peptidi ynë të mund të kalojë nëpër teste dhe të arrijë pacientët me AD pa shumë vonesë dhe të shpëtojë simptomat e tyre njohëse, që është shqetësimi kryesor i pacientëve dhe familjeve të tyre.
Referenca: “Peptidi frenues i lidhjes së mikrotubulave-dinaminës PHDP5 shpëton të mësuarit hapësinor dhe deficitet e kujtesës në minjtë model të sëmundjes Alzheimer” nga Chia-Jung Chang, Zacharie Taoufiq, Hiroshi Yamada, Kohji Takei, Takami Tomiyama, Tomohiro Tamoyukia, 6 maj 2024, Hulumtimi i trurit.
DOI: 10.1016/j.brainres.2024.148987
Studimi u financua nga Universiteti i Diplomuar i Shkencës dhe Teknologjisë në Okinawa.
